П3.1.11. О
контроле концентрации серебра в водных растворах
Как отмечалось в разд.
П3.1.8 и 9, процесс серебрения воды сопровождается переходными процессами при
включении ионатора. Дальнейшие исследования показали,
что переходные процессы имеют место не только при включении ионатора,
но и после его выключения.
При проведении серебрения с использованием электродов
ЭС-ЭНС завода ДИОД было замечено, что после выключения питания процесс
выделения наночастиц серебра в виде постепенно
сужающейся струйки продолжается достаточно длительное время. Если в начале
процесса струйка в виде перевернутого гриба распространялась перпендикулярно
днищу стеклянной банки, то после выключения питания она, постепенно сужаясь по
своему сечению, меняла угол распространения, вытягиваясь в одну из сторон
днища. Это наблюдалось при расстоянии как 2, так и 4 см от нижней части (торца)
электрода до днища банки.
Таким образом, и после выключения питания ионатора процесс электролиза продолжается, что объясняется,
на наш взгляд, наличием «остаточного» межэлектродного напряжения. Поскольку
наблюдаемое явление прерывалось при перемещении электродов, то для проверки
высказанной гипотезы соединительный кабель картриджа жестко закреплялся
(относительно банки с водой и электродами) и сразу после выключения питания ионатора выход картриджа подключался к электрометру на рис.
П3.1.35 и измерялась зависимость «остаточного» напряжения от времени. При токе
электролиза 1,6 мА и времени 30 с полученная зависимость в
табличной форме выглядит следующим образом:
|
t, мин
|
0
|
2
|
4
|
6
|
8
|
10
|
12
|
14
|
16
|
|
U, мВ
|
700
|
490
|
380
|
300
|
270
|
252
|
237
|
225
|
214
|
Полагая, что эта зависимость
является экспоненциальной функцией типа U(t) = Uo(1 – e–t/t), где Uo = 700 мВ, нетрудно определить и постоянную времени
процесса, например, по уровню U(t) = 0,5Uo =350 мВ при t = 5 мин
из очевидного уравнения: (1 – e–5/t) = 0,5, решение которого дает значение t = 7,2 мин. При токе электролиза 16 мА и времени 30 с
исследуемая зависимость имеет вид:
|
t, мин
|
0
|
2
|
4
|
6
|
8
|
10
|
12
|
14
|
16
|
|
U, мВ
|
1100
|
700
|
590
|
520
|
470
|
440
|
420
|
410
|
400
|
Из которой видно, что
постоянная времени затухающего процесса «самоэлектролиза»
того же порядка, что и при токе 1,6 мА, и существенно больше постоянной времени
начального процесса (около 20 с) при включении ионатора
(см. разд. П3.1.8).
Несколько иные результаты были получены в случае
электродов ЭС1-ЭС2 как на постоянном
токе, так и в режиме переключения электродов. На постоянном токе начальная амплитуда при
токе электролиза 1,6 мА составляла 300 мВ и через 1 мин достигала 150 мВ, т. е.
t = 1,44 мин. В режиме
переключения начальная амплитуда составляла 80 мВ и через 0,5 мин достигала 40
мВ, т. е. для такого режима t = 0,7 мин.
Приведенные данные
показывают, что переходные процессы при серебрении воды могут вызывать заметное
отличие расчетной и действительной концентрации серебра в водных растворах, что
представляет определенную опасность при их использовании в лечебных целях.
Очевидно, что наиболее радикальным способом в этом случае является определение
концентрации серебра физико-химическими методами, однако такие методы
достаточно сложны [26] и в домашних условиях трудно реализуемы. Тем не менее автором были предприняты попытки выполнить такую
работу. Поводом к такому решению явилось то обстоятельство,
что в станции автоматического управления бассейном SilverBox,
выпускаемой в подмосковном Климовске (www.acon.ru), для текущего контроля концентрации дезинфекцирующих ионов меди и серебра используется водородный
показатель рН воды в бассейне. Для проверки этой и других возможностей был
использован ионатор из раздела П3.1.9 с электродами ЭС-ЭНС от Георгия в
режимах I = 1,6 мА и 16 мА и t = 30 с, т. е. с производительностью М
= I×t = 0,0016×30
= 0,048 мг и 0,016×30
= 0,48 мг (в приводимых ниже таблицах эти данные округлялись до 0,05 и 0,5мг).
Исходная вода пропускалась через бытовой фильтр Аквафор,
ее объем, в зависимости от опыта (см. ниже), составлял 1 и 0,1 л.
В качестве измерительных инструментов использовались (см. рис.
П3.1.35):
— РН-метр 1 типа Checker компании HANNA (Германия) с пределами измерения 0…14 рН и
разрешением 0,01 рН;
— ионоселективный
электрод 2 типа ЭСС-01 с пределами измерения по серебру 5…0,38 pAg или 10–5…
1 моль/л по водному раствору AgNO3 (с учетом атомного
веса серебра, равного 107,87, это соответствует примерно концентрации ионов
серебра 1…100000 мг/л); для концентрации 3 pAg электродный потенциал нормируется на уровне 639 мВ
относительно нормального водородного электрода (НВЭ), электродный потенциал
которого в электрохимии принимается равным нулю;
— электрод
сравнения 3 типа ЭСр10101-3,5 с концентрацией электролита KNO3 3,5 моль/л; обеспечивает независящий от концентрации раствора AgNO3 электродный
потенциал (ЭП) 208±3 мВ относительно НВЭ, т. е. для системы электродов ЭСС-Эср межэлектродное напряжение (МЭН) составляет 639 –
208 = 431 мВ для концентрации 3,01 pAg (100 мг/л). Поскольку изменение рН или pAg на 1 соответствует изменению
ЭП на 59 мВ, то, согласно паспортным данным ЭСС-01, нетрудно рассчитать МЭН для
остальных нормируемых значений pAg, а именно: для pAg
= 5 (1 мг/л) оно равно 314 мВ, для pAg = 4 (10 мг/л) — 373 мВ, для pAg
= 2,05 (1000 мг/л) — 488 мВ, для pAg = 1,13 (10 г/л) — 542
мВ, для pAg = 0,38 (100
г/л) — 586 мВ; для калибровочного раствора AgNO3 концентрацией 1 г/л (pAg = 2,05) МЭН
составило 477 мВ, что на 11 мВ меньше паспортного;
— система
электродов 4 типа ЭНС-ЭС (нержавсталь-серебро);
— система
электродов 5 типа ЭНС-ЭНС (нержавсталь-нержавсталь).
В качестве
материала для ЭНС использовалась листовая нержавеющая сталь толщиной 0,3 мм и
размером 20 ´ 20 мм, а в
качестве ЭС — серебряная «шляпка» от конденсатора ЭТО. Технология изготовления
этих электродов несколько проще рассмотренной в разд.
П3.1.9 благодаря использованию в качестве несущей
конструкции 6-гранной (для электродов 4) и 4-гранной (для электродов 5)
державки от шариковой авторучки. В обоих случаях расстояние между электродами
составляло около 8 мм; соединительные проводники пропускались через полую часть
державки с заглушкой на супермоменте со стороны торца
электродов.
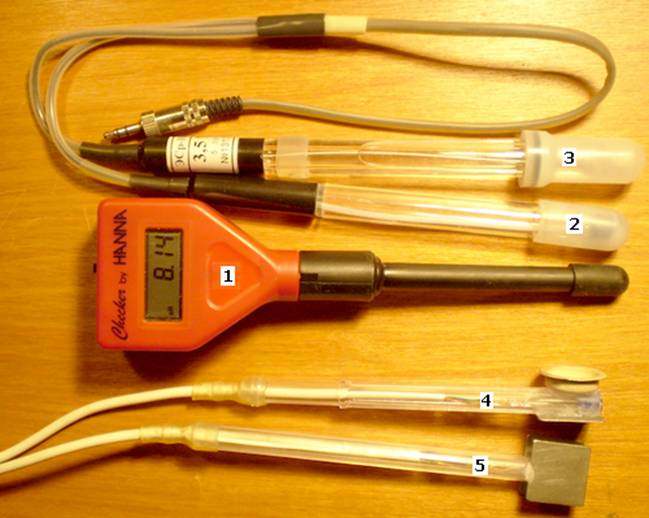
Рис. П3.1.35.
Измерительные электроды и приборы
Для измерения
межэлектродного напряжения использовался электрометрический
усилитель на операционных усилителях (ОУ) серии TL08x компании Texas Instruments с входными током 5×10–12А и сопротивлением 1012 Ом, что
вполне достаточно для работы со стеклянными электродами рН-метрии. Входной каскад выполнен на одноканальном
ОУ TL081 (см. рис. П3.1.36), отличающемся от двухканального (TL082) и четырехканального (TL084)
возможностью установки нуля (выводы 1, 5 и резисторы R5, R6).
Регулировка коэффициента усиления резистором R6 обеспечивает
калибровку в режиме аквариумного рН-метра в диапазоне
рН = 3…5,75, а резистором смещения R11 — в
диапазоне рН = 5,9…8,5 (сведения взяты на сайте
http://www.aquarix.de для самодельного рН-метра на счетверенном ОУ TL084). Питание
усилителя осуществляется от однополярного источника напряжения 12 В и стандартного преобразователя полярности на ОУ2б, R13, R14 и комплементарной паре транзисторов Т1, Т2.
При
разомкнутой перемычке П1 ОУ1 работает в режиме
повторителя (режим милливольтметра). В этом же режиме резистор R11 переводится в нижнее положение (напряжение
смещения на входе ОУ2а равно нулю). При этом ОУ2а работает в режиме
инвертирующего усилителя с коэффициентом передачи на постоянном токе R12/R9 = 1,
выполняя одновременно роль низкочастотного фильтра за счет включения в цепь
обратной связи конденсатора С1. В качестве
регистрирующего прибора, подключаемого к зажимам «Вых»,
использовался цифровой мультиметр В7-41 с входным
сопротивлением 10 МОм.
Входной
разъем «Вх» — типа моно-миниджек
диаметром 3,5 мм, к контакту 1 которого подключен высокоомный
резистор R1 типа КИМ сопротивлением
100 Мом. При замкнутых контактах 1, 2 перемычки П2
(рабочий режим милливольтметра или рН-метра) через
этот резистор на вход 3 ОУ подается калибровочное напряжение 60 мВ с делителя
на резисторах R7, R10 (нестандартное сопротивление резистора R7 подбиралось из партии резисторов МЛТ-0,125 с
номинальным сопротивлением 100 кОм), что позволяет контролировать калибровку
милливольтметра перед каждым подключением измерительных электродов к разъему «Вх», при котором его контакты 1 и 2 размыкаются
и тем самым автоматически отключается R7. При размыкании контактов 1, 2 перемычки П2 и замыкании ее контактов 2, 3 резистор R7 подключается к общей шине и в этом случае
производится установка нуля ОУ1 и ОУ2а при нулевом напряжении смещения на входе
последнего.
Выбор
сопротивления резистора R7 указанного
на схеме номинала диктовалась в первую очередь возможностью имитации режима
работы измерительных электродов как источников напряжения с внутренним
сопротивлением порядка 100 Мом. При этом учитывается также влияние этого
сопротивления на смещение нуля ОУ1 и его устойчивость:
при открытом входе 3 ОУ1 возбуждается на
частоте около 100 кГц. Заметим, что каких-либо средств экранировки не
требуется. Кроме того, усилитель отличается весьма высокой временной
стабильностью: в течение нескольких недель ни разу не понадобилась подстройка
нуля.
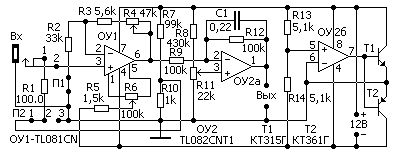
Рис. П3.1.36.
Электрометрический усилитель
Результаты
измерения рН обогащенного серебром раствора и
межэлектродного потенциала для электродов 4 представлены в табл. П3.1.2 при
9-ступенчатом изменении концентрации на 0,05 мг/л (8 включений ионатора при токе 1,6 мА и времени 30 с;
нулевая концентрация соответствует исходной воде) и в табл. П3.1.2а при последующем 6-ступечатом изменении концентрации на
0,5 мг/л (6 включений ионатора при токе 16 мА и
времени 30 с). Из приведенных данных видно, что наибольшее изменение рН = 0,08 наблюдается при первом цикле серебрения (с = 0,05
мг/л). При последующих циклах это изменение составляет около 0,04 рН на каждую ступень вплоть до концентрации 0,3 мг/л с
последующим почти десятикратным уменьшением при концентрациях от 0,35 до 3,4
мг/л.
Для электродов 4 (ЭНС-ЭС) наибольшие
изменения МЭН наблюдались в области низких концентраций и волнообразными
изменениями в области высоких.
Табл. П3.1.2
|
с, мг/л
|
0
|
0,05
|
0,1
|
0,15
|
0,2
|
0,25
|
0,3
|
0,35
|
0,4
|
|
рН
|
7,08
|
7,16
|
7,2
|
7,23
|
7,3
|
7,35
|
7,39
|
7,41
|
7,44
|
|
ЭНС-ЭС, мВ
|
50
|
61
|
80
|
87
|
85
|
85
|
95
|
80
|
84
|
Табл. П3.1.2а
|
с, мг/л
|
0,9
|
1,4
|
1,9
|
2,4
|
2,9
|
3,4
|
|
рН
|
7,49
|
7,53
|
7,59
|
7,64
|
7,66
|
7,71
|
|
ЭНС-ЭС, мВ
|
84
|
84
|
64
|
73
|
80
|
86
|
Для электродов 5 (ЭНС-ЭНС) МЭН из-за
одинакового материала электродов было близко к нулю. Для
электродов 1 и 2 (ЭСС-Эср) МЭН колебалось в пределах
200±8
мВ при любой концентрации, включая и исходную воду, что объясняется, на наш
взгляд, коллоидным характером получаемых растворов, состоящих из взвешенных в
воде наночастиц серебра, а не его ионов Ag+, как это имеет
место в случае водных растворов AgNO3. Для обеспечения
работоспособности системы электродов ЭСС-Эср,
очевидно, необходимо растворить эти наночастицы в
азотной кислоте согласно формуле: Ag + 2HNO3 = AgNO3 + NO2 + H2O. Для проверки этой гипотезы в
объеме воды 100 мл был приготовлен раствор серебра с расчетной концентрацией
4,8 мг/л. Согласно приведенной химической формуле для приготовления одного
грамм-эквивалента AgNO3 требуется 107,87 г Ag
и 2(1 + 14 +3×16)
= 126 г HNO3
(приведенные числа соответствуют атомным весам серебра, водорода, азота и
кислорода). Поскольку нам требуется растворить 4,8×10–3
г серебра, то из условия пропорциональности необходимое количество HNO3 составит 126×4,8×10–3/107,87
= 5,6×10–3
г. При плотности HNO3, равной 1,352
г/мл (использовалась кислота концентрацией 57%), требуемый ее объем составляет
5,6×10–3/1,352
= 4,15×10–3
мл. Такой маленький объем в нашем случае задавался погружением в исследуемый
раствор стеклянной палочки, предварительно смоченной в HNO3. После перемешивания наблюдалось
уменьшение МЭН с 211 мВ до 196 мВ. После многократного (до 15
мл) увеличения дозы HNO3
(для раствора — до рН = 1) МЭН уменьшалось до 160 мВ,
а спустя 10 мин после перемешивания увеличивалось до 370 мВ, что, как видно из
приведенных выше данных для ЭСС-Эср, соответствует концентрации по раствору AgNO3 в диапазоне 1—10 мг/л (pAg
= 5—4) со средним значением по МЭН (370 + 314)/2 = 343,5 мВ при концентрации 5 мг/л. Полагая, что в указанном диапазоне зависимость МЭН от концентрации AgNO3 линейна
и учитывая отклонение МЭН при pAg = 2,05 в 11 мВ, из пропорции получаем концентрацию
по AgNO3 равной 5×(370 + 11)/343,5 = 5,546 мг/л. Поскольку
AgNO3 содержит 107,87×100/(107,87 + 14 + 3×16)
= 63,5% серебра, то концентрация по серебру составит 5,546×0,635 = 3,52 мг/л, что на 26,6 % меньше
расчетного (4,8 мг/л). Если учесть, что в результате добавки 15 мл HNO3 расчетная
концентрация конечного раствора уменьшилась до 4,8×100/115 =
4,174 мг/л, то указанное отличие составляет 15,7%. Из полученных результатов
следует, что расчетное значение концентрации серебра с погрешностью около 15%
соответствует ее действительному значению.

